-
UV-vis SpectroscopyInstrumental Analysis 2022. 7. 31. 22:30반응형
1. UV-vis Spectroscopy
1) 정의
① 정의: 물질과 자외선/가시광선의 상호작용을 이용한 분석법
ㄱ. 흡광광도법(absorptiometry): 시료 중의 분석 성분에 대하여 또는 흡광 물질로 변화시킨 다음 흡수되는 광의 강도로부터 그 성분을 정량하는 방법→ 소량만 있어도 ok!
a. 미량 성분을 신속하게 분석 가능!, 정확도와 재현성이 뛰어나고, 기기조작이 간단하여 가장 넓게 사용되는 대표적인 기기분석 방법
b. 분광 광도계(spectrophotometer)를 이용하여 스펙트럼을 측정하고 이를 해석함으로써 물질에 대한 다양한 정보를 제공→시각화 해서 해석에 용이함!
ㄴ. 자외/가시부 스펙트럼: 파장에 따라서 변하는 흡광도의 변화를 나타낸 그래프
a. 물질의 종류와 성질에 따라 흡수하는 광의 파장과 흡광도가 다르므로 흡수 스펙트럼을 이용하여 각종 화합물의 정성, 정량, 화학 구조의 추정, 검체의 조성 결정 등등 광범위한 분야에서 응용함!
② 빛: UV와 visible light은 전체 빛들 중 오직 적은 부분만 해당함!

ㄱ. 최외각전자의 전이를 유발하는데 최적임!(valance electronic excitation)
ㄴ. 200~400nm 그리고 최대 800nm까지가 가장 많이 쓰이는 파장대
ㄷ. 주로 빛을 흡수시키거나 reflectance에 사용하는데 reflectance는 사용 빈도가 낮음
ㄹ. 흡수한 빛의 상보색을 띄게 됨!
a. quinone: yellow, chlorophyll: green
b. 2,4-dinitrophenylhydrone derivatives of aldehydes and ketones: conjugation 상태에 따라서 밝은 노랑부터 deep red까지!
c. aspirin: colorless→가시광선 말고 다른 파장대의 빛! ∴우리 눈에는 그 빛이 안 보임
무색=전자전이에 있어서 가시광선영역이 흡수 방출되지 않는다는 의미!
*sunlight: 모든 빛들이 다 있는데 이거를 프리즘에다 통과시키면 굴절되어서 다 분리됨!

UV-vis부터 IR 등등등 매우 다양한 빛들이 분리됨! 2) Characteristics of UV-vis spectra of Organic Molecules
① highly conjugated 된 상태가 아닌 이상 UV를 대부분 흡수함!
② spectra are broad, usually to broad for qualitative identification purposes
③ excellent for quantitative Beer’s Law type analyses→정량에서 사용 多
④ the most common detector for an HPLC
2. UV-vis absorption Spectrum
1) 형태

① 200~400nm(near UV)에서 400~800nm(violet light~red light; 가시광선영역)까지
② excite에 필요한 energy level에 해당하는 wavelength를 갖는 빛이 흡수되면 이러한 형태로 나타남!
③ 공식:
ㄱ. A=absorbance, IO: the intensity of the incident light, I: the intensity of the light transmitted through the sample
ㄴ. 빛은 단일 파장이 얻어지도록 단색화 장치(monochromator: 프리즘, 회절발 또는 필터)를 통과함! →but! 장치에 따라서 전 파장대를 다 사용하여 측정하기도 함!

2) Beer’s Law

① 사용되는 여러 측정값들
ㄱ. IO, I, concentration, thickness(b; 담겨 있는 유체를 통과하는 빛의 거리) →농도와 거리가 중요함! 이에 따라서 빛의 세기가 변하기에…., T(transmittance; 투과도→T=I/ IO), ε(고유 흡광도)
ㄴ.
a. quantitative determination of inorganic, organic and biological species에 사용됨!
ㄷ.
a. Bouguer-Lambert law: 농도 c가 일정할 때 b가 증가할수록 IO에 비해 I가 감소함. 따라서 흡광도 A는 b에 비례한다. →Lambert의 법칙이라고 불림

b. Beer’s law: identical to Bouguer’s law, except that it is stated in terms of concentration→ the amount of light absorbed is proportional to the number of absorbing molecules through which the light passes. 이는 두께가 일정할 때 농도 c가 증가하면 흡광도가 증가함을 의미함

② ★Lambert-Beer 법칙★: 분광광도법을 분석화학에 응용함에 있어서 가장 중요한 핵심이 되는 식
ㄱ.
Io라는 강도의 단색광이 성분농도가 c인 액층(b)를 통과했을 때, 투과광의 강도가 I로 되었다면 다음과 같은 식이 성립함

ㄴ. 이때 T=I/IO라고 할 때 양변에 로그를 취해 정리하면 다음과 같은 식이 나옴. 이때 K=ε(고유흡광도). 이를 통해 액층 두께b가 일정하면 흡광도는 농도에 비례함을 알 수 있음

③ Beer-Bouguer-Lambert Law=Beer’s law→ 결국 그냥 다 섞은 거….
로그를 취해서 linear expression을 한 것! 농도, 두께에 있어서 일적선으로 나타내려고!

④ 해석:
ㄱ. 만약 투과도가 100%? 그러면 흡광도는 0
ㄴ. 만약 투과도가 0%? 그러면 흡광도는 무한…
ㄷ. 만약 투과도가 50%? 그러면 흡광도는 log2=0.3010
⑤ 정량분석에서의 활용

ㄱ. 농도변화에 따른 흡광도 변화를 측정함→ 이를 통해서 미지의 시료의 농도를 구할 수 있음!
linearity를 통해서 역추적 가능! 농도와 흡광도가 비례한다는 관계를 통해서!!!
ㄴ. For quantitative analysis
a. maximum absorption and minimum absorption을 사용함! λmax, λmin을 사용!
b. 이러한 absorption spectrum은 chemical structure에 따라서 달라짐= finger print와 같음
c. it is possible to identify a substance or to test the purity of a substance by comparing the spectrum of a sample within the specified wavelength range with the spectrum of reference standard→최대최소를 비교하면서!
But 주로 concentration은 maximjm absorption을 통해서 측정함!
d. molar absorbtivity: 상수!!! 1몰일 때 얼마만큼 흡수를 하는가

→ ε값을 신물질 보고할 때 같이 알려줌! logε형태로든 ε든! *비흡광도&몰흡광계수
E1cm1%=A/(c(%)*b), ε=A/(c(mol/L)*b)
검액의 농도가 1%(w/v), 액층의 두께(b)가 1cm일 때의 흡광계수를 비흡광도(specific absorbance) 또는 E 값이라고 하고, E(1%cm-1)로 표시함

→단백질은 분자량을 정확하게 알기 어렵기 때문에 비흡광도를 사용하기도 함! 이를 통해서 유추 가능???
2. 자외가시부 스펙트럼과 발색단
1) Electronic transitions and spectra of atoms
① 정의: 전자를 낮은 에너지 준위에서 높은 에너지 준위로 이동시키기 위해 필요한 에너지
ㄱ. 이러한 것에 필요한 에너지들은 very narrow해야함! 그 에너지 준위 차이만큼 딱!
ㄴ. HOMO(highest occupied molecular orbital)에서 LUMO(lowest unoccupied molecular orbital)로 이동! →이러한 gap에 따라서 필요한 에너지가 달라짐!
② E for molecular vibration and rotation: superimposed on the electronic energy levels→전자전이에 필요한 에너지가 더 크니깐!

ㄱ. many transitions with different energies can occur, the bands are broadened
ㄴ. the broadening is even greater in solutions owing to solvent-solute interactions
③ 자외선 및 가시광선 영역의 전자파 에너지와 공명하는 작용기: 주로 공유결합성 유기화합물의 최외곽 전자가 연관된 σ, π, 및 n 결합
ㄱ. 분광학적 선택 규칙(selection rule): 전자들의 이동은 같은 종류의 오비탈간에서 가장 확률이 높으며 이종간의 전이는 주로 관찰되지 않음!
ㄴ. σ→ σ*, π→ π*는 전이될 확률이 높아서 강한 흡수를 보이지만 σ→π*, π→σ*는 잘 관측 x
ㄷ. 또한 n전자는 오비탈의 형태가 σ, π인 어느 것과도 일치하지 않기에 n→π*이나 n→σ*는 σ→ σ*, π→ π*에 비해 낮은 흡광도로 측정됨
ㄹ. σ결합이 연관된 전이는 흡수 파장이 상대적으로 짧아서 일반적으로 이용되는 자외선-가시광선영역인 200~800nm의 단파장 영역 밖으로 벗어남!=에너지를 많이 필요로 함
a. σ→ σ*전이는 모든 화합물에서 많은 전이가 존재하므로 분석적 변별가치가 없음
b. 따라서 실질적으로 중요한 전이는 π→π*전이와 n→ π*전이가 남게 됨~>이 두가지는 각각 K-band(π→π*)와 R-band(n→ π*)라고 구별하여 부르기도 함
④ Atomic and Molecular orbitals
ㄱ. 오비탈의 종류에 따라서 필요한 에너지들이 달라짐!

π→π* 와 n→ π*가 적당한 길이의 파장을 갖는다 ㄴ. 나머지 애들은 200~800nm의 범위를 벗어나서 활용하기에는 어려움!
ㄷ.

. ⑤ Types of Transitions
ㄱ. σ→ σ*, σ→π* transition: high energy, accessible in vacuum UV(λmax<150nm)…. Not usually observed in molecular UV-vis! e.g. CH4 λ=125nm
ㄴ. n→σ*, and π→σ* transition: non-bonding electrons(lone pairs), wavelength(λmax)가 150~250nm
→saturated compounds로 CH3OH 등이 있음… → 관측이 잘 안 될 수도!!!
ㄷ. n→π*이나 π→π*: 제일 많이 사용됨! λmax=200~700nm
ㄹ. 이렇게 해당되는 영역에 필요한 에너지들이 필요함!
⑥ orbital theory

ㄱ. 170 nm에 해당하는 빛 에너지를 받으면 HOMO에서 LUMO로 변하게 됨!
ㄴ. 1,3-Butadiene은 217nm에서 최대 흡광도를 보임! →λmax=217nm, logE=-4~>ε=104
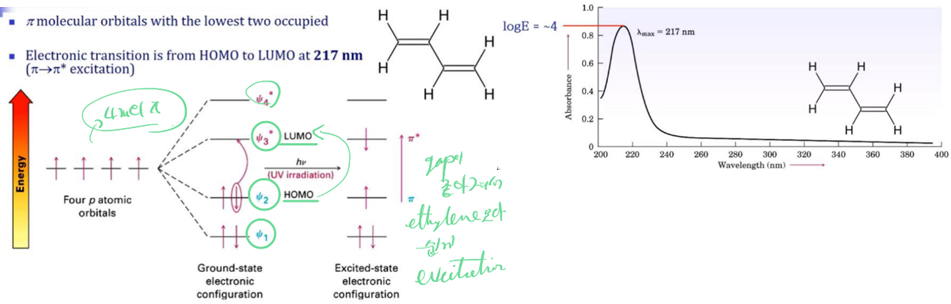
ㄷ. 이러한 특징에는 특정 구조가 많은 영향을 줌. 생긴 것은 완전히 달라 보여도 분자 안에 공통적인 특정 구조가 있으면 비슷한 영역 대에서 유사한 흡광도를 보임.

3. 발색단(Chromophore)
1) 발색단이란?
① 정의: 분자내 자외선-가시광을 직접 흡수하는 기능을 하는 관능기= a region in the molecule where the energy difference between two different molecular orbitals falls within the range of the visible spectrum
ㄱ. 자외선-가시광선에서 주요 시그날을 보이는 발색단은 π전자를 가진 이중결합과 n전자쌍을 제공하는 N, 또는 O원자를 포함하는 관능기가 발색단이 됨→O,N을 갖고 있거나 conjugation이 일어나야 한다는 것!
ㄴ. 특정한 부분에 대해서만 나타나고 분자 전체의 구조를 직접적으로 보여주지는 않음!

ㄷ. 어떤 특정 부분들은 흡수를하고 나머지 부분은 통과시키거나 반사시킴! →전자가 ground state에서 excited state로 넘어감!

a. 파장이 너무 낮으면 눈에 안 보이는 경우도 있음…..

b. 이러한 conjugation범위가 넓어질수록 energy gap 차이가 줄어든다!= λmax가 conjugation이 많으면 많을수록 증가한다!!!

c. 같은 물질에 붙어있는 작용기의 종류에 따라서도 최대 흡광도를 나타내는 부분이 달라진다!

d. ring을 추가하면 흡수하는 파장의 길이가 점점 커진다!
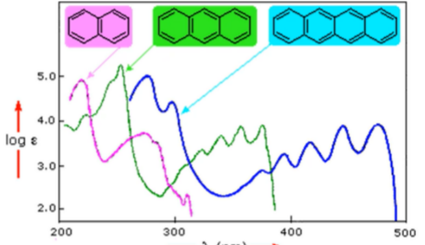
*점점 커지면 낮은 소리에 공명하는 것과 같은 원리로 보면 됨!!
*Sunscreen: UV-B:295nm~320nm→casuing sun burn!! 하는 빛을 흡수함!!!
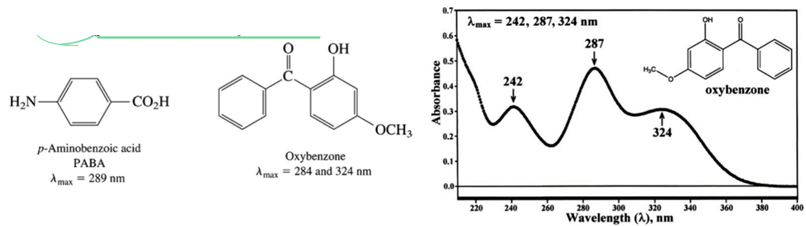
효율적으로 sunburn 을 일으키는 영역대를 흡수함 ! 2) UV-visible spectroscopy in structure determination
① Quantitative analysis of known compound: good!!!

② Qualitative analysis for unkwon compound: not good as IR
이렇게 유사한 구조면 비슷한 파장 대에서 검출됨! 따라서 물질들을 구분하기에는 좋지 않음!
4. 조색단(Auxochrome)助色團
1) 조색단이란
① 정의: 분자 내에는 발색단 이외에도 자신은 빛을 흡수하지 못하지만 발색단의 흡수파장과 흡광도에 영향을 미칠 수 있는 관능기를 의미함!
ㄱ. 파장의 이동 시그널의 장파장 이동(bathochromic shift; red shift), 단파장 이동(hypsochromic shift; blue shift)
ㄴ. 빛의 흡광량의 변화: 흡광 증가(hyperchromic shift)와 흡광 감소(hypochromic shift)
ㄷ. 이러한 조색단에 의한 변화를 면밀히 분석함으로써 발색단 이외의 전체적 분자구조에 대한 정보를 얻을 수 있음
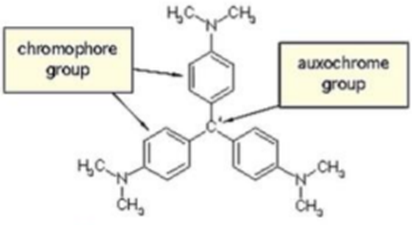
빛을 내는 구조& 그 빛에 영향을 주는 구조 ② Auxochrome에 의한 영향: hypsochromic, bathochromic& hyperchromic, hypochromic 이렇게 4가지가 있음

ㄱ. bathochromic shift(=red shift): 파장이 긴 곳으로 이동하는 것→-OH, NH2와 같은 functional group이 붙으면!!! or two or more chromophore가 conjugated 될 때, 용액의 pH가 변화할 때
ㄴ. hypsochromic shift(=blue shift): 파장이 짦은 곳으로 이동하는 것→ removal of conjugation by changing pH or polarity of the solvent
ㄷ. hyperchromic effect: 흡광도가 증가하는 것!
ㄹ. hypochromic effect: 흡광도가 감소하는 것!
③ effects of substitution


flavonoid에서 붙는 치환기의 종류에 따라서 달라짐! 5. Experiment

1) Quantitative Application of UV-vis spectrum
① 특징
ㄱ. organic&inorganic에 둘 다 사용 가능!
ㄴ. 10-4~10-5M 농도로 detection limit가 있음! 주로 정량에 사용함!
ㄷ. moderate to high selectivity
ㄹ. good accuracy
ㅁ. ease and convenience of data acquisition
② Calibration
ㄱ. theoretically, an absorbance measurement of only one standard of known concentration is required in order to calibrate for quantification
ㄴ. errors can result if the calibration curve is not accurately characterized

ㄷ. 방법
a. 최소 3 지점에 대해서 필요하지만 the most ideal?? →5지점에 대해서 측정하는 것이 좋음
b. the concentrations should start at just above the estimated concentration of the unknown sample and should go down to about an order of magnitude lower than the highest concentration→ 하나 제일 높은 거 만들고 서서히 농도를 낮추면서 만들기→
c. 이러한 것들은 wavelength dependent 하기에 적절한 wavelength를 선택하는 것이 중요하다! 보통 파장들 중 가장 흡광도가 높고 linearity가 높은 파장을 사용한다!
③ General Process of Measurement for UV-vis Absorbance
ㄱ. steps in carrying out a colorimetric analysis
a. choose the wavelength of maximum absorbance→λmax 찾기
b. prepare a calibration curve using known quantities of the complex measured at this wavelength
c. measure the absorbance of your unknown sample
d. calculate the concentration from the equation of the best fit line
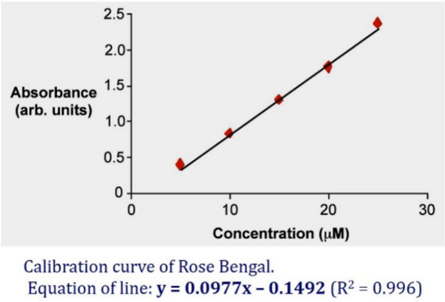
2) Solvents for UV/vis spectroscopy
① 주의할 점
ㄱ. 자외-가시부 스팩트럼은 보통 시료를 용매에 녹여서 측정
ㄴ. 용매는 정제하여 사용하고 특히 chloroform은 분해하기 쉬우므로 주의를 필요함
ㄷ. 용매는 측정하려는 물질을 투명하게 잘 녹임. 용질 분자와 반응하든가 반응X. 불순물X. 동시에 측정 파장영역에서 흡수X. 고순도로 쉽게 구하는 것!
ㄹ. 휘발성이 큰 용매를 사용하는 경우: 취급 중에 용매가 휘발하면 시료 용액의 농도가 변화할 수 있으므로 유의해야 함!
ㅁ. 모든 용매는 일반적으로 단파장 쪽에서 강한 흡수를 나타내지만 장파장 쪽으로 이동함에 따라 차차 흡수는 약해지고, 나중에는 전혀 흡수를 나타내지 않음
ㅂ. 단파장 쪽으로 측정할 수 있는 하한선의 파장을 그 용매의 흡수한계파장(cutoff)이라고 함
ㅅ.

증류수는 흡수하는 영역이 UV-vis 영역에서 멀어서 측정하기 좋으나 polarity 때문에 그닥 좋은 용매가 아니다! ㅇ. 용매들 중 시료의 흡수파장 대와 용매의 흡수 파장 대가 겹치지 않는 것을 사용할 것!

→일반적으로 ethanol과 methanol이 좋음! 적당한 polarity와 UV-vis영역의 빛은 흡수하지 않아서!!! 3) Solvents Effects
① 용매의 종류나 극성에 따라 흡수 파장이나 흡광도가 변화하는 경우도 있음→구조의 해석이나 정량분석에 유용하게 활용 가능함!
② 특히 용액의 pH의 변화는 시료의 해리 정도를 변화시켜서 스팩트럼상의 상당한 변화가 있을 수 있음
③ 따라서 표준 스팩트럼과 시료 스팩트럼의 비교를 시도하는 경우라면, 용매의 조성, pH, 이온의 농도 등이 동일하도록 조절해야 함!
④ Shift
ㄱ. Blue Shift(hypsochromic shift)
a. increasing polarity of solvent→ better solvation of electron pairs(n level has lower E)
b. peak shifts to the blue(more energetic!!!) →30nm정도
ㄴ. Red Shift
a. increasing polarity of solvent, then increase the attractive polarization forces between solvent and absorber, thus decreases the energy of the unexcited and excited states with the later great
b. peaks shift to the red→5nm정도!

어떤 용매에 녹이는지에 따라서 최대 흡광도를 보이는 파장이 달라짐! 6. Measurement Errors
1) 빛의 흡수법칙 A=εbc→흡광도가 흡수 화학 종의 농도에 비례한다는 것을 의미함
① 그러나 이 흡수 법칙이 항상 정확하게 적용되는 것은 아님
ㄱ. 이 법칙은 대부분의 물질의 묽은 용액(≤0.01M)에 대해 아주 잘 맞음
ㄴ. 이 보다 더 높은 농도일 때는 잘 맞지 않음
a. 시료 용액 중에서의 시료 분자들 간의 각종 상호 작용→농도가 높거나 이온 세기가 큰 용액에서는 용질 분자들은 가까이 있기 때문에 서로 영향을 미침~> 더 이상 그래프가 맞지 않음!
b. 때로는 용액 중에서 빛을 흡수하지 않는 용질들은 흡수 화학 종과 상호작용을 하며 겉보기 흡광 계수를 변화시킴
② wavelength accuracy and precision
ㄱ. 입사광의 단색성이 떨어지는 경우에는 흡수 법칙에서 벗어나게 됨→ 정확히 그 파장에 대해서 흡수가 일어나는 것이 아니기 때문!
ㄴ. 슬릿의 폭에 따라서 어느 정도의 파장 범위를 가진 빛이 입사광이 되므로 Bouguer의 법칙에서 벗어나는 결과가 생기게 됨!
ㄷ. 입사광이 얼마나 단색광에 가까운지에 따라서 흡광도가 달라짐!

→SBW는 사용하는 빛이 얼마나 단색광에 가까운지를 의미함
→NBW는 시료가 그 빛을 얼마나 흡수하는지를 의미함!
a. the accuracy of any measured absorbance depends on the ratio of the instrumental spectral bandwidth(SBW) to the natural bandwidth(NBW) of the absorbing substance
b. The SBW is defined as the width, at half the maximum intensity, of the band of light leaving the Monochromator(백색광에서 단색광만 뽑아내는 장치).

c. the NBW is the width of the sample absorption band at half the absorption maximum
ㄹ. SBW/NBW ratio 가 0.1 또는 그보다 작을 때는 정확도가 99.5% 이상으로 나옴! →0.1보다 크면 정확도가 낮은 것으로 간주!

20nm의 빛에 대해서는 단색광과는 거리가 멀다! SBW가 영 파이다…. 2) Stray light(단색광 이외의 모든 빛)

① stray light: stray광이 있는 경우도 파장선택기에서 선택되는 파장 이외의 빛이 시료를 통과하여 검출기에 도달함=purity에 대한 내용이다!
ㄱ. 대개 stray광은 시료에 의한 흡수가 적어서 측정된 흡광도는 실제 흡광도보다 작은 것으로 나타나게 됨
ㄴ. stray light is light in an optical system, which was not intended in the design→단색광 이외의 모든 빛
ㄷ. absorbance 계산: T=(I+IS)/(IO+IS) →투과된 빛의 양이 적으면 stray light의 영향이 커지게 되는 것임! I<IO이기 때문에 흡광도가 커지면 커질수록 stray light의 영향력이 커지게 됨!

ㄹ. Twyman Lothian Curve
a. error가 최소가 되는 범위를 의미함!
②파장에 따라서?
ㄱ. when samples absorb too strongly? Becomes nonlinear!

a. 붉은색은 농도가 낮을 때만 linearity를 보임
b. 푸른색은 농도가 어떠하든 linearity를 보임
ㄴ. 범위 내에서 최대치의 λ를 쓰면 직선성이 생김

a. λ의 범위 내에서! → max는 241nm이지만 그 범위 안에 266nm가 linearity는 더 강하게 나타난다!
7. Application of UV/vis spectroscopy
1) Quantitative Analysis of Known Compounds→water lab.에서 주로 사용됨
* medicinal chemistry: compound ID(steroids, nucleosides), monitoring isomerization, chirality
* pharmaceutical biotechnology: 농도와 순도, conformation of protein drugs
* pharmacokinetics/ Med. Chem: HPLC monitoring and purification
① 흡광광도측정법을 이용한 의약품 확인시험
ㄱ. identification: UV 흡광광도법은 대한민국 약전에서 의약품의 확인 시험에 널리 사용됨!
a. 흡수극대파장(λmax)과 극소파장(λmin)을 측정한다.

b. 여러 흡수 극대파장에서의 흡광도의 비는 의약품의 확인 및 순도 측정 등에 중요하게 이용됨!

c. 표준시료와 비교해서 일치하는지 확인한다!

ㄴ. Confirmation wavelengths

a. a simple way to verify quantitative analytical results is through confirmation analysis
b. if the sample is pure, the results at the analytical wavelength and at the confirmation wavelength or wavelengths will be identical
c. if the sample is contaminated, it is highly probable that the contaminant will contribute a different absorbance value at the analytical and conformation wavelength or wavelengths, and results will differ
*이러한 파장들을 약들마다 고유로 갖고 있음!!!
2) 의약품 정량분석에 응용
① E값(비흡광도)를 쓰는 방법

ㄱ. 시료용액(a g/v dL)의 흡광도 A를 층장 1cm에서 측정하여 순물질의 비흡광도 E1cm1%를 기준으로 한 시료 중의 순물질의 양(x mg)을 다음 식을 이용하여 구함
② 표준품을 쓰는 방법(standard addition)

ㄱ. 일정량의 시료 용액에 표준물질의 농도를 0에서부터 단계적으로 변화시키면서 가한 용액의 흡광도를 각각 측정→원래 시료에 첨가해서 변화를 측정!
ㄴ. 그림에서 직선이 흡광도가 0인 가로축과 만나는 점(C1)이 시료의 농도가 됨!

ㄷ. 예시

③검량선을 쓰는 방법(calibration curve)

ㄱ. 표준 용액을 농도 별로 따로 만들어서 시료와 비교하기!
ㄴ. y=ax+b 형태로 나타내어서 역으로 추정 가능!
→원래는 복잡한 공식을 통해서 이를 나타내지만 엑셀 프로그램을 이용하면 뚝딱!
3) Colorimetric analysis of Fe
① 색깔이 없는 화합물에 대해서! Magic drug(coloring reagent): 착화합물을 만들어서 색깔을 띄게 함!

ㄱ. various color reagents를 이용해서 착화합물을 형성하는데 이때 주로 colorless analyte에 대해서 Fe2+를 사용한다. 이를 통해 colored complex가 형성되고 이는 electromagnetic spectrum에 대해서 반응하게 됨!
ㄴ. 이후 이를 통해서 앞서 한 과정들을 진행함! λmax를 찾고 이후 linearity에 대한 정보를 찾기!
② Detecting Potassium Permanganate(KMnO4) →violet color를 갖고 있음! 520nm에서 최대 흡광도를 가짐!
ㄱ. 얘도 calibration 가능!!!

8. Determination of Equilibrium constant: 측정에 있어서 상태에 따라 최대 흡광도가 어떻게 달라지는가???
1) pH의 변화에 따라서!

2) 그 외… flow injection analysis detection, process control and kinetic measurements

이는 hydrolysis reaction of sultone에 대한 그래프로 disappearance of the reactant and the appearance of the product에 따른 최대 흡광도의 변화! 반응형'Instrumental Analysis' 카테고리의 다른 글
Infrared Spectroscopy(IR) (0) 2022.08.03 Fluorescence Spectroscopy (0) 2022.08.03 Spectroscopy (0) 2022.07.31 Liquid Chromatography (0) 2022.07.30