Infrared Spectroscopy(IR)
1. 적외부 스펙트럼 측정법
1) 원리
① 분자 내에서 원자는 진동이나 회전을 하고 있는데 이러한 원자의 움직임에 의해 분자는 적외선 영역의 특정 파장의 빛을 흡수함
ㄱ. 흡수되는 빛의 파장은 분자의 크기나 다른 부분의 구조와는 거의 관계 없이 분자 내의 원자간 결합에 특징적인 것임
ㄴ. 이것을 해석하면 원자 결합의 종류나 분자 내의 작용기(관능기) 등에 대한 정보를 얻을 수 있음
ㄷ. 이러한 특성을 이용한 방법을 적외부 스펙트럼 측정법(IR; Infrared Spectroscopy)라고 부름
② 사용하는 빛 영역
ㄱ. 일반적으로 자외선 영역이라 함은 2.5~25μm(4000~400cm-1)의 범위를 일컬으며, 0.8~2.5μm(12.500~4000cm-1)의 영역을 근적외선(near infrared)라고 하고, 25~2000μm(400~50cm-1)의 영역을 원적외선(far infrared)라고 부름→원적외선 영역은 주로 무거운 원자에 대한 정보를 얻음!

ㄴ. 주로 사용하는 영역은 파장λ: 2.5~15μm이고 파수는 4000~670cm-1이다.
2. 분자의 기본진동방식
1) 진동방식
① 특징
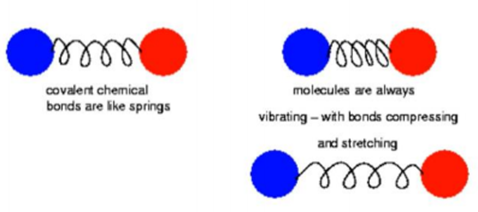
ㄱ. 분자는 원자가 움직일 수 없게 서로 결박된 것이 아님
ㄴ. 분자를 이루고 있는 원자에 상당하는 다양한 질량의 공과, 분자의 화학결합에 상당하는 다양한 강도의 용수철로 이루어진 체계와 닮았다고 말할 수 있음→신축성이 있는 용수철이라 생각해야함!
ㄷ. IR radiation is not enough to bring about the kinds of electronic transition(excitation) as in UV-vis but can vibrational or rotational excitation

a. 이러한 변화들은 두 개 혹은 그 이상의 원자들 간의 binding energy가 변하기 때문이다.
b. 각 원자들은 주변의 모든 원자들과 interacting 함!

ㄹ. IR radiation을 흡수하기 위해서는 분자가 vibration이나 rotation에 의한 dipole moment의 net change를 겪어야 함.
a. molecules with dipole moments are IR active

② the absorption of energy
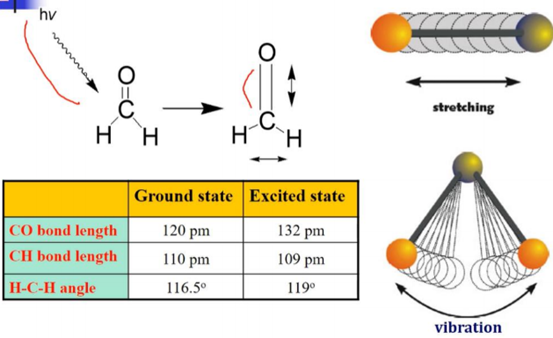
ㄱ, 분자 내 에너지는 양자화 되어 있음
ㄴ. IR: 1014Hz~1013Hz의 진동수를 갖고 파장이 2.5μm~15μm인 빛을 사용
ㄷ. 이로 인해서 bonding이 vibrate& stretch함.
3) 진동
① 기본적으로 2가지의 진동이 있음
ㄱ. 신축진동(stretching vibration): 동일 결합 축 상에 있는 2개의 원자의 거리가 증가하거나 감소하는 진동→결합의 축 방향으로 일어나며 결합 거리의 변화를 수반함

a. 대칭 신축진동&비대칭 신축진동이 있음
b. 일반적으로 비대칭 신축진동이 대칭 신축진동보다 높은 진동수에서 일어남
ㄴ. 변각진동(bending vibration): 3개 이상의 원자가 형성하는 결합 각도가 변화하는 진동→ 한 개의 원자에 공통으로 결합된 두 원자의 결합 각도가 변화되는 진동

a. 동일 평면 내에서 변각(면내 진동; in-plane bending)
b. 평면을 떠나서 변각(면외 변각진동; out of plane bending)
c. 진동의 방향이 같은가에 따라서
→면내 변각진동: 좌우흔듦진동(rocking)과 가위질진동(scissoring)
→면외 변각진동: 앞뒤흔듦진동(wagging)과 꼬임진동(twisting)으로 구분
② 특징
ㄱ. 어떤 하나의 결합의 신축진동 및 변각진동은 각각 양자화된 일정한 진동수로 진동함
ㄴ. 이들과 똑같은 진동수의 적외선이 분자에 조사되면, 그 빛의 에너지가 흡수되어 분자의 진동의 진폭이 커지게 됨
ㄷ. 흡수된 에너지는 분자가 들뜬 상태에서 바닥상태로 되돌아갈 때 열로서 다시 외부로 방출됨!
ㄹ. 일반적으로 신축진동이 변각진동보다 높은 에너지를 필요로 하므로 높은 진동수를 가짐
③ 상호작용하는 원자들의 개수
ㄱ. 원자들이 상호작용할 수 있는 입자들에 있어서 최대치가 있음; 진동하는 방법 수에 대한 한계가 있음! → the degrees of freedom이라고 부름
ㄴ. 일반적으로 a molecule with N atoms has 3N-6 normal modes of vibration→이원자 분자!! HCl 이런 애들!
ㄷ. linear molecule일 경우에는 3N-5 normal modes of vibration
e.g. water molecule

e.g. vibrations of a methylene group(-CH2-) in a molecule


ㄹ. 이러한 여러 가지 진동 중에서도 분자의 쌍극자 모멘트(dipole moment)를 변화시키는 것이 적외선의 흡수를 보임

a. 분자 내부 전하 분포의 변화로 인하여 전기장이 변화되고 이것이 전자기파를 흡수하기 때문
b. 쌍극자 모멘트의 변화가 클수록 흡수가 강하게 일어남!
c. IR에서 signal? → stretch에 대한 신호들을 중점적으로 관찰함!

d. 실제 분자의 느낌??

결합 간의 길이가 다 다름! →짧은 거는 촘촘하기에 진동 시키는데 보다 많은 에너지가 필요로 하고
→긴 거는 느슨하기에 진동 시키는데 적은 에너지를 필요로 함!
④ 적외선 흡수 에너지
ㄱ. 적외선의 흡수 과정을 이해하기 위해 용수철의 양끝에 두 개의 공이 매달려 있는 조화진동자로 가정함!

ㄴ. 이것이 진동할 때의 진동수(v)는 Hooke의 법칙에 의해 용수철의 힘상수(k)와 양쪽에 매달린 공의 중량(m1, m2)의 함수로 표시할 수 있음

a. 일반적으로 단일결합에 있어서 힘상수는 5x105dyn/cm이고 이중, 삼중결합의 경우는 각각 단일결합의 2배, 3배가 됨
ㄷ. 적외선 흡수 에너지
a. 결합의 차수가 증가하면 힘상수가 커지므로 진동수도 같이 커진다!!!

b. 같은 차수의 결합에서는 환산 질량이 커질수록 진동수는 작아진다.

c. 혼성화는 힘상수에 영향을 주며 sp3<sp2<sp 순으로 힘상수가 커진다.

d. 공명은 결합 차수와 결합 거리를 변화시켜 힘상수에 영향을 미친다. 일반적으로 C=O는 1715cm-1에서, C-O는 1100cm-1에서 흡수를 일으키나 다음 화합물의 C=O는 1675~1680cm-1에서 흡수대를 보임. 이것은 공명으로 인하여 C=O의 결합 거리가 길어지고 단일 결합성을 더 했기 때문임!!!

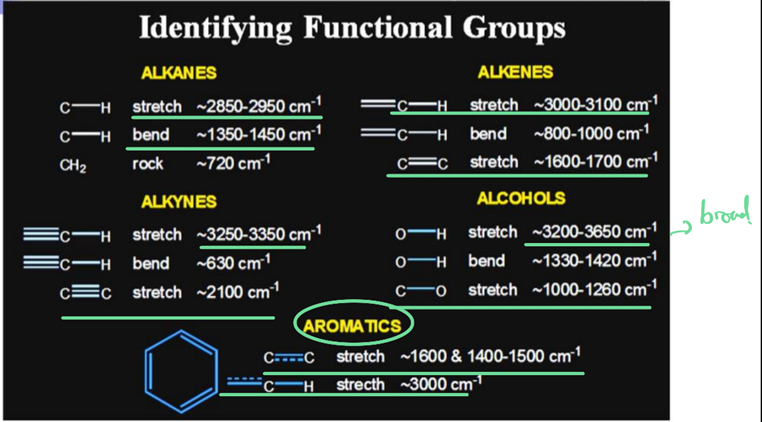
⑤ Regions of the Infrared Spectrum



ㄱ. 유기화합물이 자외.가시부 스펙트럼은 비교적 단순하여 소수의 흡수극대밖에 보이지 않으나, 적외선 흡수 스펙트럼은 매우 많은 흡수대를 나타냄!
ㄴ. 이들의 흡수대는 정확히 해당 결합에 귀속할 수 없는 것도 수 없이 많으나, 귀속이 가능한 것만으로도 분자의 구조에 관한 귀중한 정보를 얻을 수 있음.
ㄷ. 물질의 적외선 흡수 스펙트럼은 그 물질의 화학 구조에 따라 제각기 다르며 이것을 이용하여 물질을 확인하거나 또는 정량 할 수 있음
ㄹ. 적외부 스펙트럼 측정법에서는 일반적으로 빛의 흡수대를 파수(wavenumber)로 나타내는데 이것은 cm-1로 파장의 역수임
a. 파수의 단위는 cm-1(카이저)~>독일의 물리학자 이름에서 따온 거!
b. v(cm-1)=1/λ(cm)
⑦Typical Infrared Spectrum

ㄱ. 100% transmittance=no absorption
ㄴ. 적외부 스펙트럼
a. 적외 흡수스펙트럼에서 흡수대의 강도: 투광도(transmittance) 또는 흡광도(absorbance)로 표시!
b. 투광도: 원래 빛의 강도에 대한 시료를 투과한 빛의 강도의 비율
c. 흡광도: 투광도의 역수의 상용로그→log(T-1)
d. 적외 흡수 스펙트럼을 직접 제시할 필요가 없으나 지면이 제한되어 있을 경우에는 주요 흡수대의 파수, 흡수를 일으키는 작용기 및 흡수의 정도 등에 관한 정보를 문자나 기호 등으로 나타낸다. → 이때, 흡수대의 크기는 반정량적인 s(strong), m(medium), w(weak)의 기호로 표현한다.
e.g.
3. Instrumentation→ UV와 비슷함!

4. IR Sample Preparation
1) 방법
① 시료의 상태
ㄱ. Liquid: IR cell, window mataerial→ 녹여서 사용해야 함!
ㄴ. Solid: pellet→ 번거롭지 않아서 주로 고체 상태로 많이 사용하고 함
② 준비 과정


5. Application: 화합물의 구조 추정
1) 기본내용
① 해석하는 법
ㄱ. 적외선 스펙트럼은 그 특성 별로 몇 가지 영역으로 구분하여 볼 수 있음
ㄴ. 4000~1300cm-1 영역은 작용기 영역(functional group region)이라고 하고 1500~650cm-1 영역은 주로 흡수 띠들이 조합 패턴에 의하여 화합물 내 기능기들의 전체적 배치를 알아낼 수 있는 지문영역(fingerprint region)으로 구분됨!
ㄷ. 작용기 영역은 단일결합, 이중결합, 삼중결합성 관능기들의 신축진동에서 기인하는 시그널이며 흡수 띠를 특정 결합과 명확히 1:1 대응시킬 수 있는 영역임
ㄹ. 변각진동은 여러 개의 진동이 서로 간섭하여 생기는 신호들의 특정한 모양의 형태를 분석함으로써 구조의 해석에 이르게 됨!

②화합물의 구조 해석 순서
*적외선 분광스펙트럼에 의하여 미지 물질의 구조를 추정하기 위해서는 중요한 작용기의 유무를 결정해야 함. 효율적으로 이용하기 위해서는 어느 정도의 숙력이 필요하므로 초보자는 쉽게 인식이 가능한 C=O, O-H, N-H, C-H 등의 흡수대를 우선 관찰하는 것이 유리함!
ㄱ. C=O: 1820~1660cm-1에서 강 한 흡수가 있다. 가끔 스펙트럼 중에서 가장 강하며 보통의 폭을 갖고 있음. 이 흡수대의 인식은 매우 중요함! 산무수물인 경우 1810cm-1와 1760cm-1에서 두 개의 C=O흡수를 보인다.
ㄴ. O-H:3400~2400cm-1에서 넓은 흡수(보통 C-H와 중복되어 나타남), 수소결합이 없으면 3650~3600cm-1에서 좁은 흡수가 일어남
ㄷ. N-H: 3500cm-1 근처에서 보통 강도의 흡수, 경우에 따라 비슷한 두 개의 흡수대를 보인다.
ㄹ. C-H: C-H 신축에 의한 3000~2850cm=1에서의 흡수대는 거의 모든 화합물에서 관찰되므로 크게 중요하지는 않음… 알데하이드인 경우 2850~2750cm-1에서 두 개의 약한 흡수를 나타내며, 방향족과 vinyl의 C-H는 3150~3000cm-1에서 흡수된다. Alkyne의 경우 3300cm-1 근처에서 강한 흡수가 있음
ㅁ. C-O: 1300~1000cm-1에서 강한 흡수가 있음
ㅂ. C=C: 지방족은 1650cm-1에서 약한 흡수, 방향족은 1650~1450cm-1에서 보통 또는 강한 흡수를 보임
ㅅ. C=N: 2250cm-1 근처에서 보통 강도의 날카로운 흡수를 보임
ㅇ. C≡C: 2150cm-1 근처에서 약하고 날카로운 흡수가 있고, 이것은 acetylene성 C-H(3300cm-1)로도 확인이 가능함
ㅈ. NO2: 1600~1500cm-1와 1390~1300cm-1에서 2개의 강한 흡수가 있다.
2) Hydrocarbon
① 탄화수소의 스펙트럼

ㄱ. 화합물 중 기본적으로 존재하는 C-H 결합은 주변 환경에 크게 영향을 받지 않으며, 3000cm-1 전후에 비교적 강한 흡수 띠를 나타냄
ㄴ. 이 때에 포화탄화수소의 C-H는 2800~3000cm-1쪽에 보이며, 벤젠환이나 불포화 탄화수소의 C-H는 3000~3100cm-1 사이에서 관찰됨.
ㄷ. 이것은 sp3 혼성형의 탄소보다 sp2와 sp 혼성형의 탄소가 s 오비탈의 비중이 높아서 C-H 결합을 강하게 하는 경향이 있기 때문으로 판단됨. →강할수록 파수가 커지게 됨!
② alkane: sp3에 의한 C-H stretch

ㄱ. butane: 2970cm-1에서 강한 stretch가 나타남!
ㄴ. 그 외 다른 애들:
a. methane: 오직 한 종류의 signal만 나타남! Very unique하다!
b. 그러나 n-hexane과 같은 경우에는 20개의 원자들이 있음…. 따라서 생길 수 있는 stretch가 3N-6에 의하면 54개임…..
→BUT! 대부분 겹침!
→hexane의 경우에는 다양한 형태의 bond & functionality가 있음

c. octane: 중첩되는 stretch signal과 그외 다른 형태의 signal들이 있음

ㄷ. isohexane: 3개의 methyl group과 2개의 methylene group, 1개의 methyne group으로 구성 되어 있음.

a. 이러한 형태로 인해서 생기는 signal이 조금 다르게 나타남!

b. changes are observed in the distributions of the C-C skeletal vibrations, in part due to the splitting by the methyl side chain.
c. geminal한 부분이 1385~1380/ 1370~1365에서 spectrum으로 나타남!
d. n과 iso의 양상

e. isooctane: 1~4차 탄소가 모두 다 존재함→ tert butyl group과 isopropyl이 다 존재하기에

③ Alkene
ㄱ. C-H stretching은 3000cm-1이하에서 나타남
ㄴ. C=C-H와 같이 unsaturated되거나 aromatic ring에서는 3150cm-1~3000cm-1 사이의 파장이 관찰됨!
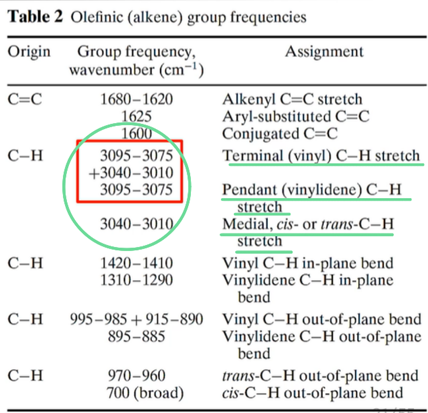
ㄷ. 예시
a. 2-ethylbut-1-ene

b. 1-hexene

c. 1-octene

d. cyclohexene

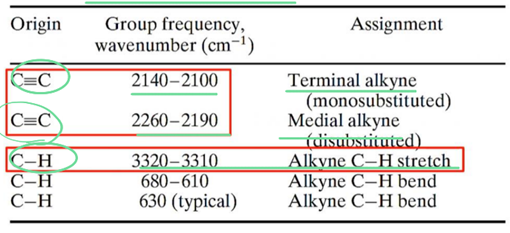
④ alkyne
ㄱ. acetylenic compound는 그렇게 흔하지는 않지만 spectrum 상에서 매우 특징적임! → C≡C
a.

c.


3) Aromatic compounds
① 특징

ㄱ. C-H와 C=C-C ring이 있음→ 이들이 vibration에 있어서 많은 영향을 준다.
ㄴ. C-H stretching occurs above 3000cm-1 and is typically exhibited as a multiplicity of weak-to-moderate bands, compared with the aliphatic C-H stretch.
ㄷ. the structure of the bands is defined by the number and positions of the C-H bonds around the ring, which in turn are related to the nature and number of other substituents on the ring.
② 예시



4) Simple Functional Groups
① 특징
ㄱ. backbone에 붙은 functional group들에 대해서!
ㄴ. 가장 간단하고 흔한 functional group은 –C-X: 다음 4개가 가장 흔함!
a. halogens, X: F, Cl, Br and I
b. hydroxyl, X: OH
c. oxy or ether, X: OR
d. amino, X: -NH2, =NH, ≡N
② Alcohol& phenol
ㄱ. 특징들
a. one of the most dominant and characteristic of all of the infrared group frequencies
b. in most chemical environments, the hydroxyl group does not exist in isolation, and a high degree of association is experienced as a result of extensive hydrogen bonding with other hydroxyl groups.
c. these hydroxyl groups may be within the same molecule(intramolecular hydrogen bonding) or they most likely exist between neighboring molecules(intermolecular hydrogen bonding)
d. the impact of hydrogen bonding is to produce significant band broadening and to lower the mean absorption frequency
e. in special circumstances, where the hydroxyl group is isolated-either because of steric hindrance effects or because the sample is in the vapor state or a dilute solution of a nonpolar solvent-the band is characteristically narrow and is observed at the natural, higher frequency.
f. 이러한 특징들은 phenol antioxidants와 같은 곳에서 주로! → 음식이나 polymer, formulated oil industry에서 많이 사용함
ㄴ. spectrum of alcoholic hydroxyl group
a. 적외선 영역의 가장 높은 에너지의 4000~3000cm-1에서 가장 중요한 기능기(O-H기의 신축 진동)
b. 실제로 순수한 O-H기의 고유 파수는 3600cm-1 이상의 흡수 파수를 가짐
c. 그러나 대부분의 알코올의 스펙트럼에서 O-H기는 3300~3400cm-1에 걸쳐 강한 흡수 띠를 보임
d. 핵산올의 OH기처럼 알코올은 일반적으로 액체나 고체의 응축상태에서의 OH 결합은 분자간 수소 결합(inter-molecular hydrogen bond)에 관여되어 있어서 결합 세기가 약해져 있으며 (3331cm-1) 일반 공유결합과는 달리 결합 길이가 유동적이어서 흡수 띠의 선폭이 다른 신호에 비하여 넓은 것을 볼 수 있음
e. 핵산올을 CCl4 같은 유기용매에 희석시켜 보면 분자간 수소 결합의 확률이 급격히 떨어져 원래의 OH 결합에 대한 흡수띠가 3623cm-1에서 선폭이 얇은 형태로 나타남!
ㄷ. 스펙트럼 양상
a. 상태에 따라서

b. 녹인 용매에 따라서

c. 파장

ㄹ. 양상

ㅁ. 차수에 따른 양상
a. primary, secondary and tertiary: -CH2OH, -CHOH, -COH가 있음
b. 몇 차 알코올인가에 따라서 OH stretch의 양상이 달라지게 됨. 하지만 근본적으로 이들은 C-O에 의한 stretching frequency의 영향을 가장 많이 받음

③ Ether

ㄱ. 특징
a. in some respects, ethers are related to alcohol and hydroxyl compounds, where the hydrogen of the hydroxyl group is replaced by an aliphatic(alkyl) or aromatic(aryl) molecular fragment
b. the overall appearance of an ether spectrum is drastically different from that of a related alcohol→이는 alcohol의 hydrogen bonding에 의해서!
c. however, many of the relationships that exist for the C-O component of the alcohol carry over to the corresponding ether.
d. the main difference is that one now considers the bonding on both sides of the oxygen, because if carbon is on both sides, then ether bonds exists.
e. ethers can exist as simple ethers(같은 게 양쪽에 달려있는 거R-O-R형태), and mixed ethers(R-O-R’)형태

ㄴ. 스펙트럼의 양상

a. the most prominent band is that due to C-O stretch, 1300~1000cm-1
b. absence of C=O and O-H is required to ensure that C-O stretch is not due to an ester or an alcohol
c. phenyl alkyl ethers give two strong bands at about 1250 and 1040cm-1, while aliphatic ethers give one strong band at about 1120cm-1.
5) Carbonyl compounds
① 카보닐의 특징들
ㄱ. carbonyl의 스펙트럼: 유기물의 관능기 중 가장 다양한 종류의 화합물을 형성할 수 있는 carbonyl 작용기는 적외선 스펙트럼에서 가장 명확하게 구분됨
ㄴ. 전형적인 케톤기의 1715cm-1을 중심으로 aldehyde, ester, anhydrous acid 순서로 흡수파가 증가하며 carboxylic acid와 amide의 carbonyl기는 흡수파가 감소하는 순서를 보여줌!

② Aldehyde
ㄱ. aldehyde는 C=O signal을 1740~1720cm-1에서 갖고 2개의 C-H signal이 2700과 2800cm-1근처에서 나타남!

③Ketone
ㄱ. 스펙트럼이 나타는 곳
a. C=O signal→ 1725~1705cm-1
b. C-(C=O)-C bending은 1300~1100cm-1부근에서 나타남!




c. mesityl oxide의 적외선 스펙트럼: α, β 이중결합이 carbonyl기와 짝지어지면서(conjugation) C=O와 C=C 모두 결합이 일정부분 약해지면서 흡수대의 파수는 작아지게 됨

d. carbonyl기는 1690cm-1로 그리고 이중결합은 1662cm-1의 흡수파를 나타내게 됨
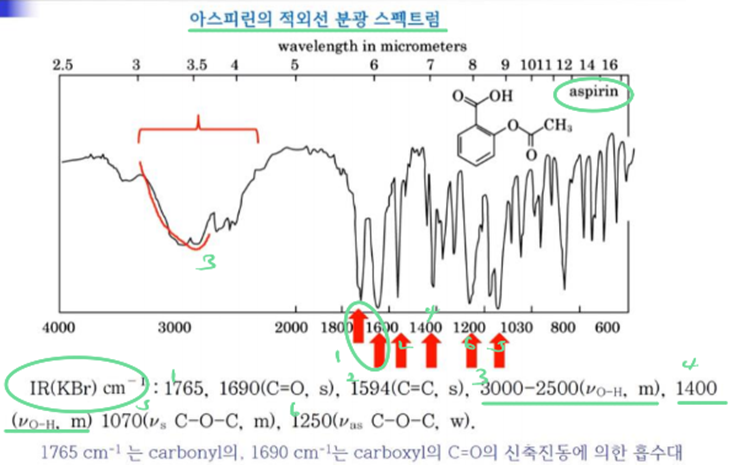
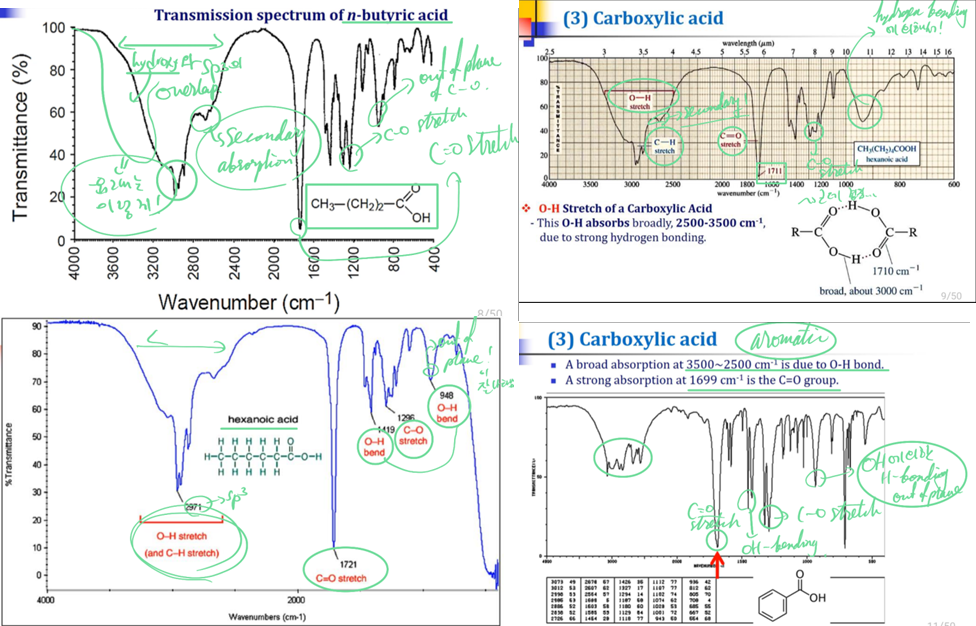
④ Carboxylic acid
ㄱ. 특징
a. carboxylic acids are good example, where the C=O, C-O-H and O-H vibrations are highly characteristic
b. a characteristic braod feature in the range 3300~2500cm-1, that overlaps the C-H stretching region, and with a secondary absorption close to 2600cm-1, is observed for the hydrogen-bonded OH of most carboxylic acids.
c. other bands that are associated with the C-O and O-H components attend to be less pronounced, and sometimes may be overlapped with other fingerprint absorptions of the molecule. → broad한 것이랑 합쳐져서 나타난다는 뜻!!!
d. C-O stretch: 1320~1210cm-1, hydrogen-bonded에 의한 bending OH 960~850cm-1
e. 1699cm-1에서 C=O에 의한 stretch가 나타남!
f. hydrogen bonding에 의한 absorption: 2500~3500cm-1에서 나타남!
⑤ Ester
ㄱ. 특징
a. C=O: stretch occurs in the range 1750~1735cm-1 in normal esters →OH에 의한 broad band X
* conjuation in the acyl portion of the molecule moves the absorption to a lower frequency; conjgation with the O in the alkoxy portion moves the absorption to a higher frequency
* ring strain in cyclic esters(lactones) moves the absorption to a higher frequency→conjuation이 잘 일어나기 때문에!!!
b. C-O: stretch in two or more bands, one stronger and broader than the other, occurs in the range 1300~1000cm-1 → ★★★ 2개 이상의 band가 생긴다는 의미!!!★★★



⑥ Amide
ㄱ. 스펙트럼
a. amide는 C=O stretch가 1680~1630cm-1에서 나타나고
b. 2개의 N-H stretch가 3350~3180cm-1(NH2)에서 나타남
c. 1개의 N-H stretch가 3300cm-1(-NH)에서 나타남
d. N-H bending은 1640~1550cm-1에서 나타남
e. C-N stretch는 1300~1400cm-1에서 나타남!
ㄴ. 특징
a. 아민과 아마이드기의 스펙트럼: 화합물 중 N-H 결합은 분자간 수소결합을 형성할 수는 있지만 O-H처럼 발생빈도가 많지 않음
b. 따라서 NH 또는 NH2기가 존재한다면 3200~3400cm-1 주변에 비교적 강한 흡수띠를 보임: 이때에 2차 아민기(a)는 단일 흡수띠를, 1차 아민(b)은 두 개의 신호가 겹치는 흡수띠를 보이는 것이 특징임
c. 또한 아마이드의 C=O는 N원자와의 짝지움(=conjugation)으로 인하여 1650cm-1까지 약화된 결합을 나타내는 것을 볼 수 있음

⑦ Acid halide
ㄱ. C=O: stretch occurs in the range 1810~1775cm-1 in unconjugated chlorides
*conjgation lowers the frequency to 1780~1760cm-1 →파수가 감소한다!
ㄴ. C-Cl: stretch occurs in the range 730~550cm-1

⑧ Anhydride
ㄱ. 특징
a. C=O: stretch always has 2 bands, 1830~1800cm-1 and 1775~1740cm-1 with variable relative intensity
b. ring strain(cyclic anhydrides) moves the absorptions to a higher frequency
c. C-O stretch: occurs in the range of 1300~900cm-1 as multibands

⑨ Carbonyl compounds 정리→making the distinction between Functional Groups with C=O’s
ㄱ. aldehyde 1710cm-1 + O=C-H stretches→ 2700&2800cm-1(추가적인 peak)
ㄴ. ketone 1710cm-1 + C-(C=O)-C bandings→ 1100&1300cm-1
ㄷ. acid 1710cm‑1 + broad OH stretch between 3500~2500cm-1 →broad 하기에 overlaping이 자주 관측됨
ㄹ. ester 1735cm-1 + C-O stretch 1200cm-1 주변
ㅁ. amide 1660cm-1 + N-H stretch 3300cm-1 주변
a. 2 peaks for RCONH2
b. 1 peak for RCONHR’
ㅂ. acid chloride 1800cm-1
ㅅ. anhydride 1800& 1750cm-1 → 이렇게 2개가 나옴
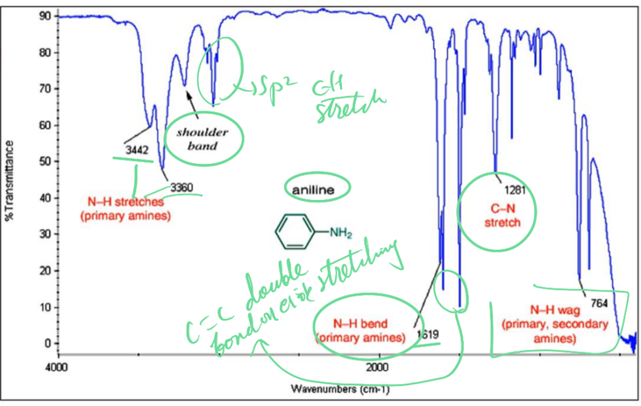
6) Amine compounds

① terminology
ㄱ. –NH2: primary
ㄴ. –NH: secondary
ㄷ. –N: tertiary
② 스펙트럼
ㄱ. in primary amine: 2개의 부분!
→asymmetrical N-H stretch
→symmetrical N-H stretch
ㄴ. secondary amines(R2NH): single weak band in 3300~3000cm-1 region
ㄷ. tertiary amines(R3N): N-H와 관련된 band가 없기 때문에 이에 대한 signal은 없음!

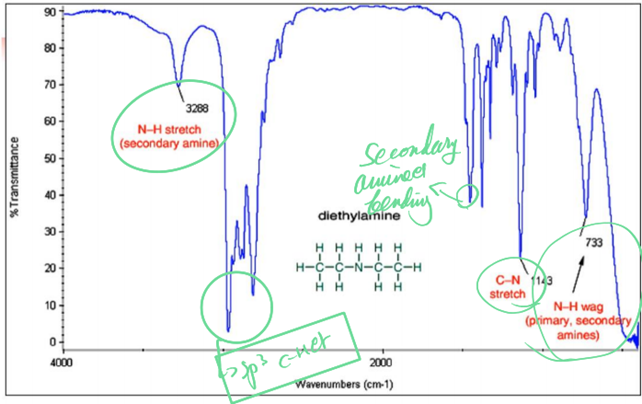

7) N-containing compounds

①Nitrile
ㄱ. C≡N triple bond: stretch is a medium-intensity, sharp absorption near 2250cm-1



② Isocyanate
ㄱ. N=C=O: stretch in an isocyanate gives a broad, intense 2270cm-1

8) Nitro compounds
① 종류

ㄱ. N-O: aliphatic nitro compounds
a. asymmetric stretch(strong하게 신호가 나옴), 1600~1530cm-1
b. symmetric stretch(medium하게 신호가 나옴), 1390~ 1300cm-1
→신호가 2개라는 뜻!!!
ㄴ. N-O: aromatic nitro compounds(conjugated)

a. asymmetric stretch(strong), 1550~1490cm-1
b. symmetric stretch(strong), 1355~1315cm-1
9) Sulfur compounds
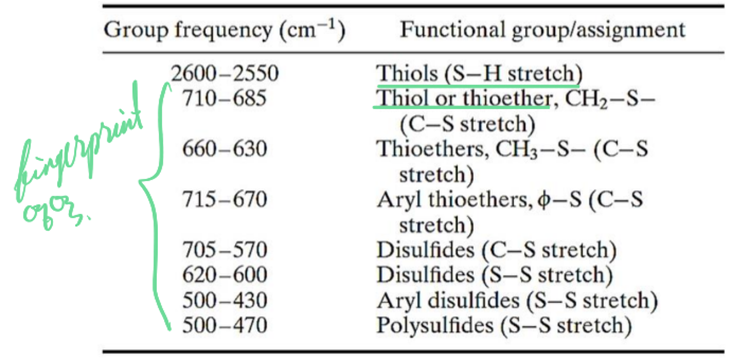
① Mercaptan
ㄱ. S-H: stretch, one weak band, occurs near 2550cm-1 and virtually confirms the presence of this group, since few other absorption appear here

② Sulfoxide
ㄱ. S=O: stretch, one strong band, occurs near 1050cm-1

③ Sulfone
ㄱ. S=O: asymmetric stretch(strong) occurs at 1300cm-1, symmetric stretch(strong) at 1150cm-1

④ Sulfonate

ㄱ. S=O: asymmetric stretch(strong) occurs ate 1350cm-1, symmetric stretch(strong) at 1175cm-1
ㄴ. S-O: stretch, several strong bands, occurs in the range of 1000~750cm-1 →여러 개의 band가 나타남!
10) Phosphate compounds: phosphine

① P-H: stretch, one strong sharp band at 2320~2270cm-1
② P-H2: Bend, medium bands, at 1090~1075cm-1 and 840~810cm-1
③ P-H: bend, medium band at 990~885cm-1
④ P-CH3: bend, medium bands at 1450~1395cm-1 and 1346~1255cm-1
⑤ P-CH2: bend, medium band at 1440~1400cm-1
11) Halogen compounds

① this only presents the group frequencies for the aliphatic compounds, because no well-defined C-X absorptions are observed for halogen- substituted aromatic compounds→ ring에 대한 정보는 명확한 것이 없다!!!
② the presence of a halogen on an aromatic ring can be detected indirectly from tis electronic impact on the in-plane C-H bending vibrations→finger print 영역에서 나타나지만 겹치는 경우가 많음…
③ do not consider the in-plane bending bands! → 다른 영역들의 신호들과 겹치기 때문에!!!

ㄱ. however, in the case of a halogen-substituted ring, the intensity of these vibrations is enhanced relative to other absorptions by as much as three to four times
ㄴ. 이것을 비교하기 위해서는 toluene과 chlorobenzene의 비교가 필요함!!!
④ 다른 예시들


6. 정리