Liquid Chromatography
1. LC란
1)정의
① liquid chromatography의 약자로 MPLC(medium pressure LC), HPLC, UPLC 등이 있음→발달함에 따라 사용하는 압력이 증가하게 됨
ㄱ. packing material이 얇아서 중력으로 불충분…. ∴고압을 사용함!
② HPLC란?
ㄱ. 분석화학에서 주로 사용하는 기법으로 separation, identification, quantitation 등에 사용한다
ㄴ. liquid 상태면 분석이 가능함! →ppt(parts per trillion)까지 분석이 가능하여 응용 폭이 매우 넓음→고정상과 이동상의 친화력 차이를 이용하여 흡착, 분배, 이온교환, 크기배제 등의 원리를 사용함
ㄷ. 활용: 약학, 식품, 화장품, 환경, 법의학, 산업 등에서 사용함
ㄹ small particle size(3~5μm)라서 강한 압력이 필요함! ~>stationary phase와 mobile phase의 상호작용이 필요함
③ UPLC(ultra performance liquid chromatography)
ㄱ. column에 1.7μm의 물질을 채움! → 15000psi(=1000bar)
ㄴ. SUPLC? → 1μm인 packing &1000000psi(=6800bar)
2. Instrumentation
*구성
① 액체 이동상을 고압으로 흘려 보낼 수 있는 펌프
② 시료를 주입하는 시료 주입기
③ 물질을 분리하는 컬럼
④ 분리된 물질을 검출하는 검출기
⑤ 검출기의 시그널을 기록 및 가공하는 자료 처리 장치
1) Pump~> high pressure pump
① 역할: 이동상을 컬럼에 흘려 보내주는 역할
→ 이동상을 정해진 속도로 일정하게 컬럼으로 흘려 보내야 함 =>4000psi이상
② 조건
ㄱ. 장비에 사용된 물질들이 solvent와 반응하지 않음
ㄴ. 분당 10ml의 flow rate→ high volume
ㄷ. precise and accurate flow: 항상 일정하게 유체가 흘러야 함
ㄹ. 고압을 필요로
③ 펌프 종류
ㄱ. reciprocating piston pump: 왕복 피스톤 펌프
ㄴ. single piston pump: 피스톤이 1개라서 왔다 갔다 할 때 흐름에 있어서 gap이 생김…. 유체의 흐름이 일정하지 않음
ㄷ. dual piston pump
a. 같은 크기의 펌프를 사용할 때: pulse free 하게 용매를 공급하여 gap 시간이 줄어듦
→하나는 piston pump, 다른 하나는 refill용!
b. 다른 크기의 펌프를 사용: 하나는 저압력, 다른 하나는 고압력! 전체 시간의 1/100 정도가 gap이라서 비는 시간 없이 계속 유체를 흘려 보낼 수 있음
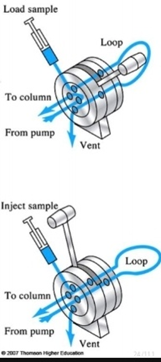
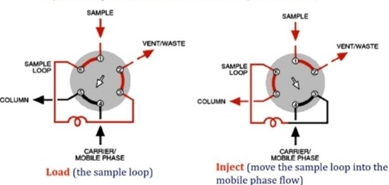
2) Injector→ column에 들어가기 직전 단계
① 정의: 고압의 용매가 계속 흐르고 있는 HPLC 등에 용매의 흐름을 방해하지 않고 시료를 컬럼에 주입하는 장치
*LC method를 이용할 때 2~3% 정도의 error는 여기서 나옴
② 방법
ㄱ. sample을 load 후 loop을 돌려서 column으로 들어가게 함
→일종의 회로를 돌려주는 느낌! Loading 시에는 column으로 들어가지 않게 line이 연결되어 있는데 loading 후 loop을 돌리면 line이 연결되어서 sample이 컬럼으로 들어가게 됨!
3) Detector
① column을 통과해서 나온 sample을 이 detector가 발견함! Chromatogram을 그려주는 장치
→ mobile phase만 있을 때랑 전기적 신호가 달라짐! 이를 detect해서 chromatogram을 그려 줌
ㄱ. GC(gas chromatography)와 다르게 LC만을 위한 detector가 없어서 따로 연결하는 장치가 필요함!
ㄴ. 조건: selectivity, sensitivity & detection limit, stability 등을 고려해야 함
a. HPLC로 잘 쓰려면?: 모든 분석 물질에 대한 감응도, 좋은 감도, 유속이나 온도의 변화에 무관해야 하며, 정량성(dynamic range), 비파괴성(용이한 시료 회수)가 필요함
b.
LOD(limit of detection): signal-to-noise ratio 가 2:1 ~3:1 정도일 때 좋음
LOQ(limit of quantitation): noise에 비해 signal이 매우 커야 quantitation 가능→10:1
※종류
v bulk property detectors: mobile phase bulk property에 반응
e.g. refractive index, dielectric constant나 density 등 àuniversal하게! All analytes에 반응함
v solute property detectors: UV absorbance, fluorescence or diffusion current 등→ 시료의 성질!
v non- destructive: UV, fluorescence, ECD
v destructive: ELSD, MS, RI 등등등
~> HPLC에서 주로 사용?: UV, fluorescence, 굴절률, 전기 화학적, 증기화 광산란검출기, 질량분석 등을 사용함
② UV- visible detector
ㄱ. 기본적인 구조: UV-vis 분광광도계와 비슷함, but 실제 분광광도계보다 많은 부분이 단순화!
ㄴ. 매우 작은 flow cell을 사용, Z자 모양
ㄷ. 종류
v variable-wavelength(spectrophotometric) detectors→ less expensive, quantitative analysis, routine assay에 활용 가능함
v photodiode array(PDA) detector
a. variable-wavelength(spectrophotometric) detector
grating 각을 바꾸어서 조사하는 빛의 파장을 변화시킴
→ 물질마다 최대 흡광도를 갖는 파장이 다르다는 것을 이용하는 것
→ 그래프로 나타내면 이런 느낌으로 나타낼 수 있음

b. Diode Array Detector(DAD)=Photodiode array detector(PDA)
v 더 강력한 UV- visible detectorà비파괴적이지만 UV를 흡수하는 애들만!
v all wavelength의 빛을 조사하여 한 번에 전 광선에 대해 검출함
~> 실시간으로 컬럼에서 나오는 시료의 UV- visible 스펙트럼을 얻을 수 있다는 장점이 있음
v photodiode array에 수 백~천 개 이상의 광 다이오드가 일렬로 배치 됨! →넓은 영역의 파장의 빛을 동시에 감지함! ~> 모든 파장에 대한 시료의 정보를 얻음
v 활용: metabolite profiling~> 직접 성분을 분리하지 않아도 안에 어
떤 것이 있는지 분석 가능!

e.g. MS를 붙이면 매우 좋음! 이온화 시키면서 분자량을 바로 측정할 수 있으니깐!!! → HPLC-MS 형태로 많이들 사용한다고 함
ㄹ. 장점:
a. 감도 好,
b. 직진성이 우수해서 정량성 好,
c. 이동상의 영향을 비교적 적게 받음 ∴ gradient를 적용하기 좋음
d. 시료 파괴 X
e. 파장을 조절해서 어느정도 선택적인 시료 검출이 가능함! → 구조에 따라 흡수하는 영역이 달라짐 → photodiode array 검출기를 사용할 수 있음
f. 사용이 편리함!
③ Fluorescence detector(FLD): UV-vis 검출기와 비슷한 장점
ㄱ. 단점: 자연계에 형광을 띠는 물질은 극소수….. 자연계에 한 15% 정도!
∴ 분석 가능한 시료의 범위가 UV-vis 검출기보다 제한적임
ㄴ. 장점
a. 형광이 있는 물질? →훨씬 선택적으로 검출할 수 있음! →π-electrons: aromatic components, conjugated double bonds, carbonyl groups, hetero atoms(aliphatic or alicyclic한 애들)
b. UV-vis 보다 100~1000배 정도 감도가 좋음 ∴미량 분석에 이용을 많이 함
*UV vs. FLD
a. UV: sample에 의한 변화량을 측정함
b. FLD: 시료가 빛을 받고 방출하는 빛을 측정함à아주 미량이라고 하더라도 detection에 유리함
→ UV에서는 검출되지 않고 약한 것들?! →FLD에서는 신호가 크게 나타남
④ Evaporative Light Scattering Detector(ELSD)
ㄱ. 과정
a. 분무: 컬럼에서 나온 용리액을 질소(공기)로 분무하여 작은 droplet형태로 만들어 줌
b. 용매 휘발: 작은 droplet을 가열된 관을 통과시켜 이동상은 휘발시키고 건조된 시료 입자만이 남게 됨
c. 산란광 검출
ㄴ. 원리: 입자의 보편적인 성질→입자의 多少에 따라 빛이 산란되는 정도가 달라지게 됨
a. nebulization: N2나 공기를 chamber에 분무
b. Evaporation:
용매를 제거→ analyte만을 남겨놓기 위해서!
analyte 특성에 따라서 온도를 조절해줌
c. detection: 빛을 조사(LED or laser)→size에 따라서 빛이 산란됨! Mass sensitive
→ 농도가 높으면 산란되는 정도가 증가함

ㄷ. 장점:
a. 만능검출기: 휘발성이 있는 모든 시료들을 검출할 수 있음
b. 좋은 감도: ng 수준의 검출을 할 수 있음~>물질의 질량과 감도가 비례함
c. 용매는 미리 휘발시켜서 용매는 peak에 나타나지 않음 → ∴ gradient를 주기 좋음
d. functional group이나 chromophore는 상관 없음! 질량에 따라서 달라짐
~> 다른 detector는 peak이 다르다고 하더라도 ELSD에서는 결과가 또 다를 수도 있음
⑤ Recfractive Index(RI) detector →용질의 보편적인 성질을 활용함
ㄱ. 원리: 어떤 물질이 HPLC 용리액에 녹아있으면 용액의 굴절률이 달라짐을 활용함
∴ 도달하는 빛의 양이 달라짐
→굴절률에 영향을 주는 거의 모든 물질을 검출할 수 있음


ㄴ. 굴절률 검출기의 특징
a. 이동상의 굴절률에 영향을 주는 모든 물질을 검출할 수 있음à거의 모든 물질들! ~>non-destructive함! 만능 검출기임
b. 감도는 좋지 않음
c. 용매의 조성에 따라서 매우 민감! ~> 기울기 용리를 적용하기는 또 어려움(gradient를 적용하기 어렵다는 말)
d. 용액의 온도와 유속에 매우 민감함→ 0.001℃변화에도 민감!
e. 비파괴적이므로 시료의 회수가 용이함!
⑥ Electrochemical Detectors(ECD)
ㄱ. 활용:
a. 산화/환원 되는 물질을 검출하는데 사용됨
b. 전극에 일정한 전압을 걸어주고 HPLC 용리액이 전극을 흐르게 함
c. 시료가 전극을 지나면서 전극에 의해 산화/환원 됨
∴ 전극에 흐르는 전류의 양이 변화~> 시료 검출
ㄴ. 장단점
a. 장점:
v 매우 감도가 좋음, 구조가 간단!
v UV보다 더 좋은 감도를 얻기 위한 목적! →picomole이나 nanogram 정도도 ok!
→UV와 비슷한 특성
b. 단점: 검출되는 화합물 종류 多→phenol, catecholamines, nitrosamines, and organic acids ∴ 선택성이 다소 떨어짐
c. 특징: analyte concentration에 비례→quantification에 사용!
⑦ Mass Spectrometry(LC-MS) → GC와는 다르게 특별한 interphase가 필요함
ㄱ. vacuum requirements! →mobile phase를 제거하기 위해서
ㄴ. LC-MS: HPLC에서 시료는 용액 but, MS에서는 시료가 기체임, &전하를 띠는 물질임
ㄷ. 시료를 기체로 만들어야 해서….
→ 예전에는 어려웠는데 요즘은 기술이 발달하여 LC-MS로 사용할 수 있음
ㄹ. 여러 interfaces? →사용 多인 방법
ESI(electrospray ionization)
APCI(atmospheric pressure chemical)
a. ESI
v LC에서 나온 용리액을 대기압 상태로 분사
v 용매를 제거한 후 용질들만 남김
v 용질들을 이온화! 수직으로 MS에 들어가게 됨
~> 장점: multiply-charged ion이 형성됨, allows for analysis of large molecules

b. APCI: interface~> ESI랑 비슷 but. 이온 형성에 있어서 다름! 분무 후 방전 시키면서 이온화
v solvent vapor acts as reagent gas→charge transfer to the analytes

ㅁ. 장단점
a. 단점: 고가&운용비용 多
b. 장점: 감도 好, 매우 선택적, 광범위한 화합물을 검출할 수 있음, 질량 스펙트럼에서 시료의 분자구조에 대한 정보를 추가적으로 얻기 가능함!
ㅂ. LC-MS의 검출 방식
a. 주사방식(scan): 넓은 범위의 m/x 갑을 검출
v 미리 정한 m/z 값의 범위를 순차적으로 주사 → 피크를 검출함
v 용리액 중 전체 화합물을 검출할 수 있음
v 각 화합물에 대한 질량 스펙트럼을 얻을 수 있음
∴전체 화합물의 분포나 물질의 구조에 관한 정보를 얻기 좋음
b. 선택 이온 검출(selected ion monitoring or recording: SIM or SIR)
→ 특정 m/z 값을 가진 peak만 검출→ 훨씬 검출 감도가 좋음
∴ 정량의 목적, 혼합물 중의 특정 화합물만을 선별적으로 분석하는데 유리함
3. Column →시료가 분리되는 가장 중요한 부분
1) 기본 내용
① 목적에 따라
ㄱ. 분석용 컬럼: 내경이 2~5mm 정도인 컬럼으로 3~10μm 정도인 particle을 분리하는 용도로 사용함
ㄴ. 분취용: 고압을 버티기 위해서 stainless steel을 사용함! But. 유리재질로 된 것도 있기는 하지만 그 수는 적다
② 형태
ㄱ. 15cm long, 4.6mm internal diameter, 5μm 입자로 packing →10000개의 plate들로 되어있음
ㄴ. guard column을 입구에 부착해줌→ 일종의 필터 역할
a. 컬럼을 보호하는 용도
b. 시료 중 컬럼과 상호작용 할 수 있는 물질들과 미리 작용하여 본 컬럼을 보호하는 목적임
c. 수시로 교체해준다
ㄷ. resin
a. preparative 용으로 사용! à 분리된 샘플이 아직 덜 정제되었을 때 이를 통해서 정리하는 용도
→ 채우는 입자(resin)의 크기가 비교적 큼
b. resin의 종류들→ analytical과 semi-preparative가 주로 연구용으로 많이 사용됨!

v analytical
v semi-preparative
v preparative
v process(industrial)
*이렇게 아래로 올수록 내경이 증가하고 길이가 증가함+ resin의 particle size가 커진다
ㄹ. 길이
a. 분리에 있어서 column length도 중요함
b. but. 길이는 매우 제한적임… ∴ recycling preparative HPLC가 있는데 이는 분취용으로 사용하는 것임! → 썼던 컬럼에 나온 용매를 다시 컬럼으로 넣어서 긴 컬럼을 굳이 쓰지 않음! →짧은 컬럼을 여러 번 돌려서 사용하는 것

2) Stationary Phases
① 종류
ㄱ. polar(normal phase): silica, alumina
ㄴ. non-polar(reversed phase): 보통 C18 or C8을 사용함. 하지만 C8이 제일 많음
→실리카 입자 또는 실리카 입자의 표면을 화학적으로 변화시킨 입자들을 사용하는 것!
ㄷ. 실리카
a. 불규칙한 모양 또는 구형 모양(분석용 HPLC에 주로 사용함)
b. 다공성 물질: 표면적이 매우 넓음→ 입자 내부까지 pore가 있음∴그 표면적이 300~600m2/g 정도 됨
c. 완전 다공성 실리카: 표면적이 넓음→시료분석 가능 용량이 커짐~>요즘은 입자가 1.7μm까지도
② HPLC의 충진물
ㄱ. 3~10μM 정도의 입자를 충진
a. 다공성의 작은 입자(3μm): 빠른 분석에 좋음
b. 다공성의 더 작은 입자들(pericullar): 훨씬 빠른 분석이 좋음
ㄴ. pore 안에서도 크로마토그래피가 일어남! ∴ pore 크기도 중요!
a. 저분자 물질을 분석? →5~12nm(=50~120Å) 정도의 pore를 갖는 입자를 사용함
b. 시료의 분자량이 10000 이상이 되어 분자 크기가 크면??? →pore의 크기도 150Å 이상으로 큰 것을 사용함


*UPLC: 충전된 입자가 1.7μm 정도. ∴resolution이 좋음. Resolution rate도 빠름→더 강한 압력이 필요함

③ Adsorbents for Chromatography
ㄱ. silica(silica gel; SiO2)가 가장 널리 쓰임
a. 기계적 강도가 강하고 완전 다공성, 여러 가지 pore 크기와 여러 가지 입자 경을 갖는 재료를 구하기 쉬움
b. 고압에 잘 견딤, 팽윤이 적고 수명이 길어야 함→HPLC 충진물로 많이 사용됨!

c. 실리카의 끝에는 silanol(Si-OH)이 노출되어 있음 →silanol에는 3가지 형태가 있음
v free silanol→산성이 강하여 염기성 물질을 강하게 흡착함
v geminal silanol
v associated silanol

*silica는 약산성 물질이라서 물에 조금씩 녹음… → 실리카를 이용한 충진제는 pH 8 이하에서 사용해야 함.
d. more polar 물질들이 non-polar보다 잘 끌림à dipole-dipole interaction에 의해서
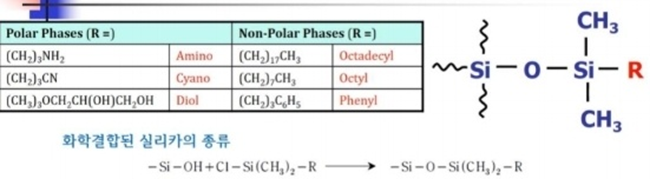
④ bonded stationary phase~> silanol group과 attachment
→specific surface interaction이 일어남!
ㄱ. 기본: fully hydrolyzed silanol goup
ㄴ. 화학 결합형 실리카(bonded silica): 분해능, 안정성, 응용성이 좋음→∴실제 HPLC에서 가장 널리 사용됨
*화학적 방법을 이용해 단분자 상태의 유기화합물 층을 만든 것
→주로 dimethylalkylchlorosilane을 이용함~>C18=RP=18=ODS로 불림
a. siloxanes
*silica:
C1(trimethylchlorosilane)
C4(dimethylbutylchlorosilane)
→이 둘은 protein separation 또는 purification에 사용
C8(dimethyloctylchlorosilane)
C18(dimethyloctadecylchlorosilane)
→가장 널리 사용됨!

*80%정도의 HPLC가 Phenyl, CN, NH2, diol 등에 의해 분리 됨
→같은 물질이라 하더라도 어떤 column인가에 따라서(고정상에 따라서) 분리되는 양상이 달라짐
*silica를 화학적으로 반응시켜도 실리카에 있는 모든 silanol이 반응하지 않음… →실제 반응하는 것은 한 50%정도! ∴표면에는 항상 silanol이 남아있고 이는 제조사마다 다 조금씩 다름
~>치환되어 있는 탄소함량을 통해 치환된 관능기의 양을 알 수 있음
*탄소함량이 증가하면 치환된 충진물에 있는 고정상의 함량이 증가하게 됨
∴ 시료는 컬럼에 더 강하게 머물게 됨=retention time 증가!

*
v 남은 silanol 기를 trimethylsilylation 시켜서 silanol기로 인한 peak 확산을 방지함
v trimethylchlorosilane(TMCS)과 같은 짧은 실릴화 시약을 사용함→dimethyl이 붙음
v but. 산성용액에서 잘 분해됨
v dimethyl 유도체 대신 diisopropyl 또는 diisobutyl기를 사용?
~>steric effect 때문에 silanol effect는 감소함&치환기 안정→내구성이 강해짐
→이를 sterically protected bonded phase라고 함.
b. styrene-Divinyl Benzene: rigidity & porosity로 물질을 분리함→다공성이 생겨서 그 공극들을 통해 물질을 분리하게 됨

* Diaion HP20, SP20SS, and HP20SS: macroporous styrenic based polymeric bead type resin임
→aromatic non-polar surface! =>hydrophobic area가 있음. ∴항체와 같은 애들에 대해서 selectivity가 좋음. ~> 중요한 biomolecule을 분리할 때 사용하기 좋음
* Adsorption mechanism: low energy van der Waal’s interactions.
* Particle size: open column? HP 20(250~600μm), SP200SS(50~100μm), HP 20SS(75~150μm)
c. Gels for Gel-filteration(size-exclusion) →sephadex, sepharose, bio-gel 이렇게 3개가 있음
4. Preparation for HPLC Analysis
1) Sample 전처리?
① 검체를 HPLC에 주입시킬 수 있는 상태로 만들어야 함
ㄱ. 어떤 것은 바로 HPLC 기기에 넣을 수 있음. 그러나 어떤 것들은 전처리가 필요하다
ㄴ. HPLC 검체: 먼저 용액 상태로 만들어 줌. + 모든 검액을 0.2~0.45μm 정도의 pore를 갖는 membrane 여과지를 이용해 여과시킴
→solid phase extraction(SPE)를 이용함~>urine, blood, water, beverage, soil & animal tissue
2) 왜 전처리를 하는 것일까?
① 불필요한 물질의 분석을 방지하기 위해서~>resolution하다가 겹치면 error! à데이터 해석의 어려움이 생김
∴ SPE를 이용해 전처리를 진행함! à baseline을 제거하는 것
ㄱ. sample이 저용량이면 저감도일 때 더더욱 분석하기 어려움

3) 장점
① 간섭요인을 제거하게 되면 chromatography가 더욱 잘 생기게 됨
② 분석 물질의 농축: higher detection sensitivity
③ 시료의 분리도와 감도를 향상시킴
4) Stationary phases: based on silica à 고정상 & 이동상에 대한 친화력의 차이
① non-polar: reversed phase C18
② polar: normal phase SPE
③ electrostatic: ionic exchange
5) 활용
① selective extractionà 특적 analyte와 흡착력이 강함
ㄱ. SPE sorbent 선택: 이거에 따라 impurities 또는 원하는 compound를 selective하게 retained 함
ㄴ. 이후 tube 안 물질을 회수 or 흘러나간 애들을 회수함

② selective washingà원하는 것을 붙여놓고 나중에 제거를 하게 되는 것

ㄱ. impurity가 씻겨나감
ㄴ. 이때 원하는 물질은 붙여 놓을 만큼 약하고 impurity는 씻어낼 만큼 강한 용매를 사용해야 함!
③ selective elution
ㄱ. 같이 있을 때 impurity가 강하게 붙어서 원하는 compound는 씻겨 나오게 됨

*이러한 것들을 이용해 정량&정성분석 모두 가능함!
5. 실제 시료의 분석
1) 탈기
① 용매에는 원래 어느 정도의 기체가 녹아있음. 따라서 HPLC 내부에 공기 기포가 발생하지 않도록 미리 탈기하는 것이 중요함.
② 탈기하는 방법: 감압, 가온, 초음파, 용매에 비활성 기체를 흘려 보내 purge하게 만들기, 온라인 탈기장치(기체만 통과할 수 있는 재질!)
*일반 실험실: 감압하면서 동시에 초음파를 쪼여줌! → 빠른 탈기 가능!
2) 용매: 보통 HPLC에서 2종류의 용매를 혼합하여 사용함!
① 강도
ㄱ. 용매의 강도가 약한 것: A 용매→시료에 대한 친화력이 약하다~>∴시료가 고정상에 머무는 시간이 커짐
ㄴ. 용매의 강도가 강한 것: B 용매→시료에 대한 친화력이 강하다~>∴시료가 고정상에 머무는 시간이 짧아짐
*이러한 분리 양상의 변화?~> 이동상의 조성, 고정상을 바꾸거나 온도를 조절함→이때 이동상의 조성을 변화시키는 것이 훨씬 쉬움~>selectivity(α)를 조절하기 위해서!
3) Analysis for Neutral Substances
① Normal phase vs. Reversed phase
ㄱ. NP?: mobile phase는 non polar하고, stationary phase는 polar함à→약한 비극성 먼저 나오고 극성이 강한 애들은 나중에 나오게 됨
ㄴ. RP?: mobile phase는 polar하고, stationary phase는 non-polar함→극성이 강한 애들이 먼저 나오고 극성이 약한 애들은 나중에 나오게 됨
→를 대부분 많이 사용함!

4) Optimization of Separation in HPLC
① 컬럼 선택 잘하기àstationary phase
② mobile phase 잘 선택하기
→isocratic: 일정 농도로 mobile phase를 계속 흘려 보내는 것
→gradient elution: 농도가 일정하게 변화함~> 기계로 변화시키는 것이라서 open column에서 농도를 변화시키는 것에 비해 연속적인 변화를 줄 수 있음
③ flow rate을 어떻게 할지
④ column 온도? Heating 여부
6. Reversed Phase HPLC(C18을 column으로 사용함) ~> HPLC 기법 중 75%가 이에 해당함
1) Stationary phase: C18(=ODS)을 주로 사용함
2) Mobile phase
① 비교적으로 polar한 애들을 사용! → an aqueous blend of water
ㄱ. A용매: water
ㄴ. B용매: acetonitrile, MeOH, THF 등
② 용매의 특성
ㄱ. viscosity(점성)
ㄴ. UV transparency: 기계에 UV 장비를 붙일 때도 있고 하니깐
ㄷ. refractive index: RI detection에서 자유로울 것 → 굴절되고 하면 검출되니깐 방해요소로 작용할 수 있음
ㄹ. boiling point: 농축 등의 처리 과정에 있어서 중요함
ㅁ. purity: 순도가 높아야 함
ㅂ. inert with sample compound→반응 X!
ㅅ. 독성
ㅇ. 가격
③ polarity에 따른 용출 양상
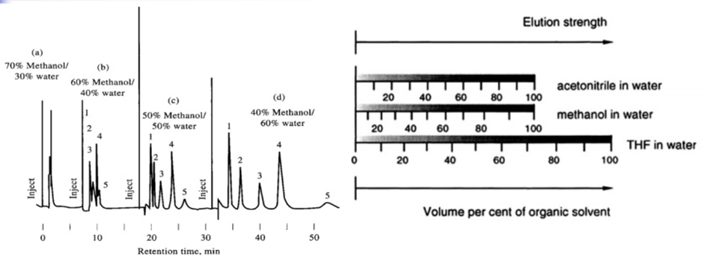
*조성에 따라서 chromatogram이 달라지게 됨
7. Normal Phase HPLC
1) Stationary Phase: polar
2) Mobile phase: non-polar~> 100% organic→ no water! 근데 가끔씩 물을 쓰기도 함
∴ 비극성 분자가 먼저 나온다


8. Gradient Elution=> GC의 isothermal이랑 비슷함
→ Isocratic and gradient
1) 정의
① mobile phase의 농도를 점진적으로 변화시킴à B 용매의 비율을 서서히 증가시켜 원하는 target만을 쭈욱 뽑아낼 타이밍을 잡아야 함!


② Isocratic: 분석 시 용매의 농도를 변화시키는 것 없음
③ Gradient 종류:
ㄱ. low pressure gradient system
a. 적정량의 2가지 이상의 용매를 섞을 수 있음
b. 벨브를 통해 용매를 다르게 연결!

ㄴ. High pressure-gradient system
a. 농도 조절이 용이함! → 0.1%까지
b. 농도 변화에 있어서 즉각 반응함
c. pump가 2개 따로 있음

2) 실제로?
① RP일 때
A: H2O
B: Organic solvent

ㄱ. 단점들
a. re-equilibration time이 길다
b. cycle 하나하나가 오래 걸림

c. resolution time이 길면 길수록 resolution이 잘 일어나게 됨
9. HPLC의 응용분야: 제약, 식품, 법의학 등에서 사용함!